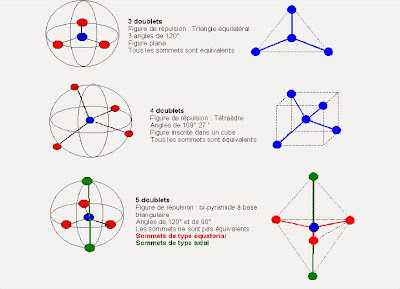
Un électron : est une particule subatomique chargée négativement. Il peut être soit libre (non attaché à tout atome), ou liée au noyau d'un atome. Les électrons dans les atomes existent dans les coquilles sphériques de différents rayons, représentant les niveaux d'énergie. Plus la coque sphérique est élevé, plus l'énergie contenue dans l'électron.
Dans les conducteurs électriques, des résultats d'écoulement actuelles du mouvement des électrons d'un atome à individuellement et de négatif à poteaux électriques positives en général. Dans les matériaux semi-conducteurs, le courant se produit également comme un mouvement d'électrons. Mais dans certains cas, il est plus illustrative d'envisager le courant comme un mouvement de lacunes d'électrons d'un atome à. Un atome déficient en électrons dans un semi-conducteur est appelé un trou. Trous de positif à des poteaux électriques négatives en général.
La charge sur un seul électron est considéré comme la charge électrique de l'unité. Il est attribué polarité négative. La charge d'un électron est égal, mais opposé, à la charge positive sur un proton ou un trou. La quantité de charge électrique ne est pas généralement mesurée en termes de charge sur un électron unique, parce que ce est une très petite charge. Au lieu de cela, l'unité standard de la quantité de charge électrique est le coulomb, symbolisé par C, soit environ 6,24 x 1018 électrons. La charge de l'électron, symbolisée par e, est d'environ 1.60 x 10-19 C. La masse d'un électron au repos, me symbolisé, est d'environ 9.11 x 10-31 kilogramme (kg). Les électrons se déplaçant à une fraction appréciable de la vitesse de la lumière, par exemple dans un accélérateur de particules, ont une plus grande masse en raison des effets relativistes.